Штучна підшлункова залоза
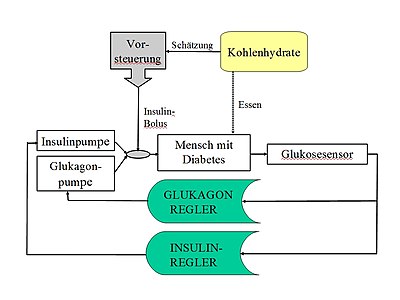
Штучна підшлункова залоза або штучні бета-клітини — це медичний пристрій, який забезпечує хворих на цукровий діабет інсуліном залежно від постійних вимірювань рівня цукру в крові . Таким чином, він імітує функцію бета-клітин, що знаходяться в острівцях Лангерганса підшлункової залози, які виробляють і вивільняють інсулін в організмі, та які руйнуються або недостатньо виконують свої функції у хворих на діабет. Робота штучної підшлункової залози більше відповідає природному вивільненню інсуліну, ніж звичайна інсулінотерапія або лікування за допомогою інсулінової помпи.
Основними компонентами штучної підшлункової залози є датчик безперервного вимірювання глюкози для визначення рівня цукру в крові, помпа для контрольованої подачі інсуліну та мініатюрний комп'ютер, який оцінює дані вимірювання датчика, та контролює роботу помпи за допомогою алгоритму для імітації циклу контролю глюкоза-інсулін. Штучна підшлункова залоза розробляється орієнтовно з 1970 року, а відповідні системи вперше випробували на людях наприкінці 1970-х років. Метою застосування апарату є тривале використання як імплантату або як пристрою, який може носити пацієнт. Натепер штучна підшлункова залоза все ще є предметом досліджень. Комерційні системи та системи біохакінгу з'явились орієнтовно з 2018 року.
Історія[ред. | ред. код]
Уперше схему штучної підшлункової залози описав у 1964 році Кадіш.[1] Починаючи з 1974 року кілька дослідницьких груп у всьому світі намагалися наблизитися до створення апарату контрольованої інфузії інсуліну, включаючи Альбісера (США), Крігена (Австралія), Міруза (Франція) і Сісірі (Японія). У Західній Німеччини над розробкою такого апарату працював Е. Ф. Пфайффер (помер 23 січня 1997) в Ульмі.[2] У Карлсбурзі в НДР У. Фішер і його колеги одночасно досліджували систему з математичною моделлю і датчиком глюкози.[3] У той же час в Японії М. Сісірі представив пристрій для підшкірного введення. В обидвох випадках не змогли розробити мініатюрні пристрої. Від цього часу в комерційне виробництво були запущені великі пристрої з неімплантованими датчиками та контрінфузією глюкози («Biostator» і «Nikkiso STG-22 Blood Glucose Controller»). З 1978 року перші підшкірні інсулінові помпи випускали компанії «Pickup» в Англії та «Tamborlane» у США. Лише після того, як розпочалось виробництво у великих кількостях надійних та з можливістю імплантації безперервних датчиків глюкози, з 2004 року розпочалось масове виробництво штучної підшлункової залози, насамперед у США. З 2000 року дослідження штучної підшлункової залози підтримувалися значною підтримкою таких установ, як JDRF, Національний інститут охорони здоров'я США та Європейський Союз. Зокрема, JDRF підтримав розробку симулятора типу 1, який після схвалення FDA значно прискорив дослідження та частково зробив непотрібними експерименти на людях[4] З 2011 року стало доступним портативне керування апаратом після розробки можливості перенесення програмного забезпечення на смартфони Android (система DIAS).
Підгрупи і види апаратів[ред. | ред. код]
Існують різні типи штучної підшлункової залози, які дещо відрізняються між собою:
- Розташування датчика та інсулінового катетера: підшкірно, внутрішньовенно або внутрішньоочеревинно
- Ступінь автоматизації
- Ступінь мініатюризації, можливість імплантування
- Місце застосування: відділення інтенсивної терапії, стаціонар, амбулаторне лікування
- Цільовий діапазон або точне цільове значення
- Введення лише інсуліну або введення інсуліну з глюкагоном або прамлінтидом
- Тип алгоритму контролю, наприклад оцінка ЧСС
Система порогового переривання[ред. | ред. код]
Завданням системи пристроїв для призупинення порогової дії інсуліну є зменшення тяжкості або недопущення небезпечного падіння рівня глюкози в крові (гіпоглікемії) шляхом тимчасового припинення подачі інсуліну за допомогою помпи, коли рівень глюкози досягає визначеного порогового значення або наближається до нього.[5] Подальшим розвитком цього напрямку є системи, які передбачають, коли буде досягнуто порогове значення (prediction, англ. predictive low-glucose suspend PLGS). У дослідженні в США з прогнозованим перериванням 78 % рівнів глюкози в крові були між 70 і 200 мг/дл вночі з PLGS, порівняно з 71 % без такого прогнозованого відключення.[6]
Системи контролю діапазону[ред. | ред. код]
Система контролю діапазону (CTR) зменшує ймовірність гіпер- або гіпоглікемії шляхом зміни дози інсуліну, коли рівень глюкози в крові наближається до вищого або нижчого порогу. Людям, які обирають цей тип системи, все одно необхідно самостійно вводити інсулін, проводити моніторинг рівня глюкози в крові та коригувати дозу інсуліну до цих значень.
Системи керування заданими значеннями[ред. | ред. код]
Системи керування заданим значенням (Control-to-target, CTT) повинні забезпечити досягнення заданого або цільового значення рівня глюкози в крові. Система працює повністю автоматично і не вимагає участі користувача, окрім калібрування.
Бігормональна система контролю[ред. | ред. код]

Бігормональна система контролю призначена для досягнення цільового значення рівня глюкози за допомогою 2 алгоритмів, кожен з яких керує насосом для гормону, що знижує рівень цукру (інсулін), і гормону, що підвищує рівень цукру (глюкагон). Такий тип регуляції краще імітує регуляцію глюкози здорового організму. У здорових людей глюкагон утворюється в α-клітинах підшлункової залози, і ще раніше схвалений як препарат для парентерального застосування при тяжкій гіпоглікемії.
Мінуси:
- Довгострокова безпека глюкагону ще не досліджена. Створити стабільну композицію важко через утворення фібрил і агрегатів у водному розчині та розкладання гормону.
Перевага:
- глюкагон має більш швидкий час початку дії, ніж аналоги інсуліну (приблизно 20 хвилин до максимуму).
Гібридна система з пілотним керуванням[ред. | ред. код]
Гібридна система дозволяє пацієнту вводити додаткову дозу інсуліну перед їжею. Ця додаткова доза знижує ризик гіперглікемії після їжі. У таких системах частково реалізовано процес прямої подачі, який є звичайним у технології керування для коригування очікуваних відхилень у параметрах. Оскільки відхилення неможливо точно зафіксувати, їх може лише оцінити користувач (оцінка кількості вуглеводів або вуглеводних одиниць), використовується частковий попередній контроль, у якому, наприклад, 50 % розрахованої дози інсуліну можна ввести заздалегідь у вигляді болюсу. У таких моделях відмовляються від принципу повністю автоматичного керування на користь кращого балансу введення гормонів, для чого потрібна допомога користувача.
Типи регуляторів[ред. | ред. код]
Модель з прогнозним керуванням[ред. | ред. код]
Регулятори з прогнозним керуванням[7] (англ. Model Predictive Control, MPC) використовуються у випадку, коли загальні регулятори (PID) не мають необхідної якості, та є достатньо часу для оптимізації керування на кожному кроці процесу. Після кожного відбору (вимірювання) користувач може наново ввести контрольні параметри на основі прогнозу.
Пропорційно-інтегрально-похідний регулятор (PID)[ред. | ред. код]
Цей тип контролера складається з трьох компонентів: пропорційний компонент, у якому маніпулювана змінна (швидкість інфузії) стає пропорційною контрольній різниці (фактичне значення рівня глюкози — цільове значення рівня глюкози); інтегруючий компонент, який забезпечує стабільну точність, але уповільнює відповідь; диференціатор, який реагує на зміни, роблячи контролер швидким, але посилює швидкі відхилення, та може зробити контролер нестабільним. З 2010 року такі регулятори, на основі фізіологічної регуляції здорової підшлункової залози, отримують зворотний зв'язок від прогнозованого рівня інсуліну (IOB) для запобігання гіпоглікемії, спричиненій надмірною інсулінізацією.
У 2017 році тільки на ринок США вийшов апарат «Minimed 670G», в якому базальна норма регулюється за допомогою PID-алгоритму зі зворотним зв'язком. Ця система не записує прийом їжі, тому її класифікують як гібридну систему.
Нечіткий контролер[ред. | ред. код]
Система нечіткого керування складається з контролера, який контролює низку дискретних вхідних значень (наприклад, 3 діапазони глюкози: високий, нормальний, низький) за допомогою нечітких правил (правила «якщо»-«тоді»), та вихідного значення (швидкість інфузії інсуліну) результату. Тут приблизні значення доз інсуліну генеруються з емпіричних знань, які близькі до рекомендацій діабетологів щодо дозування. Таким чином, нечіткий контроль базується на звичайній практиці болюсного розрахунку в повсякденному житті: пацієнт коригує між рівнем цукру 140 і 170 мг/дл за допомогою однієї одиниці інсуліну (МО) і між 170 і 200 мг/дл за допомогою 2 МО інсуліну тощо.
Архітектура зниження ризиків і безпеки[ред. | ред. код]
Неправильне вимірювання датчиком та/або неправильне використання алгоритму керування може призвести до небезпечної для життя гіпоглікемії. Також, наприклад технічне обмеження швидкості інфузії можливе за допомогою окремого алгоритму прогнозування гіпоглікемії. Зокрема, для цієї мети використовується модуль виявлення низького рівня глюкози або розрахунок інсуліну в системі для введення.
Особливості та труднощі регулювання[ред. | ред. код]
Особливістю зворотного зв'язку є тривалі затримки процесу: фізіологічною, і тому неважливою затримкою дії є затримка інсуліну в печінці на близько 100 хвилин і в периферійній тканині (м'язах) на близько 20 хвилин. Крім того, із застосуванням апарату для підшкірного введення інсуліну потенційно може додатися низка затримок на обох кінцях: час затримки приблизно 5–15 хв через датчик глюкози та тканинну дифузію, та затримка внаслідок поглинання інсуліну. Штучна підшлункова залоза також у деяких випадках не може працювати оптимально через затримки та неточності вимірювання та введення інсуліну. Порушення дії, тобто швидкі зміни, такі як прийом їжі, які спричиняють підвищення рівня глюкози, яке відбувається набагато швидше, ніж час, необхідний для всмоктування та дії інсуліну, не можна виправити. Контролер може стати нестабільним через те, що втручання в управління є занадто сильним або занадто швидким. Таким чином, регулятор повинен реагувати повільніше, що означає, що піки глюкози після прийому їжі стають більшими, і пізніше може виникнути гіпоглікемія. Через цю «контрольну дилему» контролери працюють повільно, а найкраще працюють лише вночі у квазі-сплячому стані. Разом із фізичними вправами та харчуванням з'являються такі відхилення, які особливо хочеться виправити за допомогою штучної підшлункової залози.[8] Це означає, що системи для введення часто є гібридними. У регуляції можуть допомогти інші форми введення інсуліну, такі як внутрішньоочеревинне введення або інгаляційне введення.
Цілі та показники ефективності[ред. | ред. код]
Цілями та показниками ефективності роботи штучної підшлункової залози є:
- Повна або значна передача всіх дій з лікування діабету від пацієнта до пристрою
- Стабілізація та зниження середнього рівня глікемії з довгостроковим зменшенням наслідків
- Уникнення або зменшення гострих ускладнень, таких як гіпоглікемія та кетоацидотична кома.
Запропоновано реєструвати якість і варіабельність за допомогою часу в цільовому діапазоні, що можливо за допомогою безперервного вимірювання рівня глюкози. Гібридні системи наразі досягають того, що значення глюкози знаходяться в діапазоні 70-180 мг/дл приблизно за 70 % часу вимірювання. Крім того, має сенс фіксувати час у гіпоглікемічному діапазоні. Крім того, все більшу роль відіграватиме вимірювання рівня якості життя. Існують перевірені інструменти для його вимірювання, наприклад форми для записів щодо якості життя з діабетом або страху перед гіпоглікемією. Також завжди потрібно знаходити компроміс між ступенем автоматизації та якістю контролю; саме такий компроміс між досягненням природної глікемії та кількістю небажаних гіпоглікемій. Частковий перехід управління до користувача також створює ризики, які виникають через непередбачувану поведінку людини та викликають занепокоєння щодо безпеки. Порівняльні показники встановлюються за допомогою національних реєстрів або ініціатив щодо якості («неповноцінність» порівняння найкращої поточної терапії).
Сучасні діючі системи[ред. | ред. код]
Станом на 2020 рік використовуються так звані sc-sc системи, в яких датчик глюкози та інфузійний катетер для інсуліну розташовані в підшкірній клітковині (SC). Навіть якщо значні затримки можна було б усунути за допомогою внутрішньовенного вимірювання або інфузії, з міркувань безпеки до цього часу введення інсуліну здійснювалося підшкірно. Системи можуть бути розроблені таким чином, що бездротові з'єднання (Bluetooth) і повне програмне забезпечення для керування можуть бути встановлені на мобільний пристрій (смартфон). Також можливим є дистанційний моніторинг (телемоніторинг).
Система з маркуванням CE була доступна в європейських країнах у 2015 році, та була внесена до списку допоміжних засобів державного медичного страхування Німеччини. Комерційні інтереси щодо маркетингу своїх апаратів в 2015 році мали інші системні провайдери.[9]
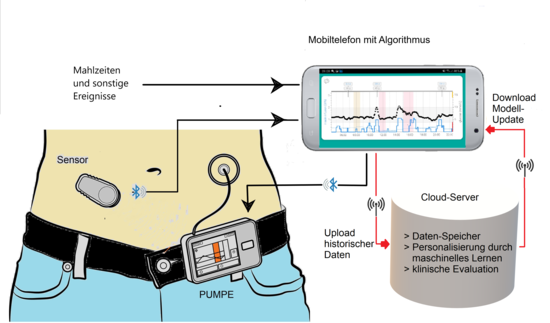
У Сполучених Штатах Америки FDA схвалила сумісність технічних пристроїв і програм для лікування діабету, якщо вони мають так звану позначку iCGM. Це дозволяє безперервно спостерігати за показниками датчиків рівня глюкози, інсуліновими помпамии та інших апаратів з алгоритмами керування від різних виробників, щоб вони змогли підключатись та взаємодіяти один з одним.[10]
Дослідження за участю реальних пацієнтів мають на меті розширити роботу пристроїв на все більш тривалі періоди, та дозволити користувачам стати більш незалежними. Спочатку це практикувалося в так званих діабетичних таборах з наглядом, а пізніше в готелях поблизу лікарень.
Дослідження 2015 року в Англії[11] повідомило про безпечне домашнє використання апаратів протягом 3 місяців і 11 % збільшення часу в цільовому діапазоні. У багатоцентровому дослідженні (переважно в США) у 2017 році система, яка включала попередній контроль прийому їжі, досліджувалась амбулаторно на 29 дорослих протягом 12 тижнів. Новим тут була щотижнева адаптація базальної дози та співвідношення інсуліну до вуглеводів (що визначає так званий харчовий болюс) на віддалених серверах. Це дозволило знизити рівень глікованого гемоглобіну з початкових 7 % до 6,7 %.[12] У багатоцентровому дослідженні 2019 року за участю 112 пацієнтів протягом 6 місяців було досягнуто подібного збільшення часу використання пристрою (часу в цільовому діапазоні).[13]
У дослідженні в США результати, повідомлені дітьми та їхніми батьками щодо якості життя (структурована анкета) при носінні штучної підшлункової залози («Tandem Control-IQ System»), не показали суттєвих переваг порівняно з терапією за допомогою інсулінової помпи.[14]
У 2021 році коротке дослідження, проведене компанією INREDA (Амстердам), змогло досягти покращення цільового часу використання пристрою з 54 % до 87 % за допомогою бігормональної системи (інсулін + глюкагон), пацієнтам не потрібно було вводити та обчислювати вручну кількість вуглеводів, та вводити дозу інсуліну перед їжею. Однак система є значно складнішою та потребує більшого обслуговування (особливо через роботу з глюкагоном).[15]
Некомерційні системи[ред. | ред. код]
З 2013 року існує глобальна спільнота, заснована за принципом «Зроби це сам» «OpenAPS» під девізом «Ми не чекаємо», яка поєднує комерційні технології для створення штучної підшлункової залози за допомогою алгоритмів і програмного забезпечення в дусі відкритого коду.[16] Серед засновників — Дана Льюїс і Скотт Лейбранд із США.[17][18]
Як і комерційні системи, «OpenAPS» і трохи новіша «AndroidAPS», є гібридними системами. Болюс інсуліну необхідно вводити перед кожним прийомом їжі. Використовується комерційно доступна інсулінова помпа та система CGM, які мають відкритий інтерфейс. Оскільки вони є медичними пристроями класів IIa та IIb, розміщення їх на ринку вимагає маркування CE. Щоб уникнути юридичних проблем, користувач повинен зібрати свій продукт самостійно. Пов'язаний APP не можна завантажити з магазину APP, натомість APP можна створити самому, для чого потрібні знання програмного забезпечення. Відповідний вихідний код є у вільному доступі.[19] Користувачеві не надаються ніякі послуги. Крім того, немає відповідальності за економічну шкоду або шкоду здоров'ю внаслідок використання.[18][20]
Для обміну ідеями з іншими «луперами» потрібне членство в соціальній мережі, такій як Facebook. Спільнота очікує, що дані користувачів будуть надаватися анонімно. За оцінкою організації «OpenAPS», станом на грудень 2021 року у всьому світі було майже 2500 її користувачів.[21] Опитування майже 900 дорослих і батьків дітей показало, що використання «OpenAPS» знизило рівень глікованого гемоглобіну в середньому майже на 1 %.[22]
Спеціальні групи пацієнтів[ред. | ред. код]
Пацієнти після панкреатектомії[ред. | ред. код]
Пацієнти після панкреатектомії вважаються нестабільними з точки зору контролю цукру в крові, та мають вищу імовірність виникнення гіпоглікемії, яка, серед іншого, причинно пов'язана з одночасною нестачею глюкагону. Стабільний стан для них є особливо важливим.
Дослідження в Амстердамі з використанням бігормональної системи показало кращий показник у цільовому діапазоні (3,9-10,0 ммоль/л, 70-180 мг/дл) — 78 % порівняно з 57 % у пацієнтів, які отримували звичайне лікування. Крім того, спостерігалося менше випадків гіпоглікемії. На відміну від систем без глюкагону, пацієнтам не потрібно було вводити вуглеводи та/або вводити болюси інсуліну перед їжею. З іншого боку, обслуговування апарату було більш складним, оскільки щодня треба було контролювати рівень глюкагону.[23]
Дослідження, проведене в Університетській лікарні в Берні з використанням гібридної системи «CamAPS HX» (від Кембриджського університету (Велика Британія)) показало довший час у цільовому діапазоні рівня цукру в крові 77 % проти 41 % для тих, хто отримував традиційне лікування. (Однак цільовий діапазон тут становив 5,6–10 ммоль/л, 100—180 мг/дл).[24]
В обох дослідженнях кількість пацієнтів була невеликою, а тривалість післяопераційного лікування була короткою, лише один тиждень (Амстердам — 10 хворих, Берн — 13 хворих). Всі пацієнти отримували «щадну панкреатичну дієту».
Примітки[ред. | ред. код]
- ↑ AH. Kadish: Automation control of blood sugar. I. A servomechanism for glucose monitoring and control. Am J Med Electron 1964;3:82–86 (англ.)
- ↑ E.F. Pfeiffer, C. Thum, A.H. Clemens: The artificial Beta-Cell: A continuous control of blood sugar by external regulation of insulin infusion. In: Horm. Metabol. Res., 1974, 6, S. 339—342. (англ.)
- ↑ U. Fischer et al. Does physiological blood glucose control require an adaptive control strategy? In: IEEE Trans Biomed Eng., 1987, 34, S. 575–82. (англ.)
- ↑ M. Vettoretti et al.: Type-1 Diabetes Patient Decision Simulator for In Silico Testing Safety and Effectiveness of Insulin Treatments. У: Transactions on Biomedical Engineering, 2018, 65, S. 1281 doi:10.1109/TBME.2017.2746340 (англ.)
- ↑ R. M. Bergenstal, D. C. Klonoff, S. K. Garg, B. W. Bode, M. Meredith, R. H. Slover, A. J. Ahmann, J. B. Welsh, S. W. Lee, F. R. Kaufman: Threshold-based insulin-pump interruption for reduction of hypoglycemia. У: The New England Journal of Medicine, випуск 369, № 3, липень 2013, S. 224–232, doi:10.1056/NEJMoa1303576, PMID 23789889. (англ.)
- ↑ T Spaic et al.: Predictive Hyperglycemia and Hypoglycemia Minimization: In-Home Evaluation of Safety, Feasibility, and Efficacy in Overnight Glucose Control in Type 1 Diabetes. У: Diabetes Care, 2017 40(3), S. 359–366. doi:10.2337/dc16-1794. (англ.)
- ↑ J Richalet et al.: Model predictive heuristic control: Applications to industrial processes. In: Automatica, 1978, 14, S. 413–428. (англ.)
- ↑ C. Cobelli et al. Advancing Our Understanding of the Glucose System via Modeling ;IEEE TRANSACTIONS ON BIOMEDICAL ENGINEERING,. 61(5): 157 (2014) (англ.)
- ↑ S. Trevitt et al. Artificial Pancreas Device Systems for the Closed-Loop Control of Type 1 Diabetes: What Systems are in Development? Diab. Sci. Technol. Листопад 2015. (англ.)
- ↑ FDA authorizes first interoperable, automated insulin dosing controller designed to allow more choices for patients looking to customize their individual diabetes management device system (англ.)
- ↑ H Thabit, M Tauschmann, JM Allen et al.: Home use of an artificial beta cell in type 1 diabetes. In: N Engl J Med., 2015, 373, S. 2129—2140 (англ.)
- ↑ Dassau et al. 12-Week 24/7 Ambulatory Artificial Pancreas With Weekly Adaptation of Insulin Delivery Settings, Diabetes Care 2017;46; S. 1719. (англ.)
- ↑ Brown et al. NEJM 2019 жовтня doi:10.1056/NEJMoa1907863 (англ.)
- ↑ E. C. Cobry et al.: Health-Related Quality of Life and Treatment Satisfaction in Parents and Children with Type 1 Diabetes Using Closed-Loop Control. У: DiabetesTechnology & Therapeutics, 2021; doi:10.1089/dia.2020.0532 (англ.)
- ↑ Fully Closed Loop Glucose Control With a Bihormonal Artificial Pancreas in Adults With Type 1 Diabetes: An Outpatient, Randomized, Crossover Trial; Diabetes Care 2021;44:836–838 (англ.)
- ↑ openaps.org (англ.)
- ↑ Dana Lewis, Scott Leibrand, #OpenAPS Community: Real-World Use of Open Source Artificial Pancreas Systems. In: Journal of Diabetes Science and Technology. 10, Nr. 6, ISSN 1932-2968, S. 1411–1411 (DOI:10.1177/1932296816665635). (англ.)
- ↑ а б Stefanie Blockus: Die kompilierte Bauchspeicheldrüse. Typ-1-Diabetiker basteln künstliche Bauchspeicheldrüsen. In: c’t. Nr. 9, S. 162. (нім.)
- ↑ Willkommen zur AndroidAPS-Dokumentation. AndroidAPS. Процитовано 14 червня 2021. (англ.)
- ↑ Martina Lenzen-Schulte: Typ-1-Diabetes: Diabetestherapie Marke Eigenbau. In: Deutsches Ärzteblatt. 116, Nr. 29-30, S. A 1378-A 1381 (https://www.aerzteblatt.de/int/article.asp?id=208999). (нім.)
- ↑ OpenAPS Community (англ.)
- ↑ K.Braune et al.: Why #WeAreNotWaiting — Motivations and Self-Reported Outcomes Among Users of Open-source Automated Insulin Delivery Systems: Multinational Survey. У: J Med Internet Res., 2021, 23(6), S. e25409; jmir.org/2021/6/e25409 doi:10.2196/25409 (англ.)
- ↑ van Veldhuisen et al.: Bihormonal Artificial Pancreas With Closed-Loop Glucose Control vs Current Diabetes Care After Total Pancreatectomy, JAMA Surg. 2022;157(10) Doi:10.1001/jamasurg.2022.3702 (англ.)
- ↑ G.Krutkyte et al.: Fully Closed-Loop Insulin Delivery in Patients Undergoing Pancreatic Surgery; DIABETES TECHNOLOGY & THERAPEUTICS 25(3), 2023 DOI:10.1089/dia.2022.0400 (англ.)
Джерела[ред. | ред. код]
- Frederick Chee, Tyrone Fernando: Closed-Loop Control of Blood Glucose. Серія: Lecture Notes in Control and Information Sciences, Band 368. Springer, Berlin und New York 2007, ISBN 978-3-540-74030-8. (англ.)
- C.Cobelli, E. Renard, B.Kovatchev: Artificial Pancreas: Past, Present, Future. In: Diabetes, 2011, 60, S. 2672; doi:10.2337/db11-0654.
- Masami Hoshino, Yoshikura Haraguchi, Iwanori Mizushima, Motohiro Sakai: Recent Progress in Mechanical Artificial Pancreas. В: Journal of Artificial Organs, 12(3)/2009. Springer, S. 141–149, ISSN 1434-7229. (англ.)
- Kavita Kumareswaran, Mark L Evans, Roman Hovorka: Artificial Pancreas: An Emerging Approach to Treat Type 1 Diabetes. В: Expert Review of Medical Devices, 6(4)/2009. Expert Reviews Ltd., S. 401–410, ISSN 1743-4440. (англ.)
- Martina Lenzen-Schulte. Typ-1-Diabetes: Diabetestherapie Marke Eigenbau // Deutsches Ärzteblatt. — 2019. — № 29-30 (27 травня). (нім.)
|