Серотоніновий транспортер

Серотоніновий транспортер (SERT або 5-HTT), також відомий як натрій-залежний переносник серотоніну, або SLC6A4 (англ. solute carrier family 6 member 4), що кодується однойменним геном. SERT є одним із видів білків-переносників моноамінів, що транспортує серотонін з синаптичної щілини в пресинаптичний нейрон.
Це зворотнє захоплення серотоніну SERTом є механізмом його дезактивації та дозволяє повторно використовувати його в наступній синаптичній передачі й здійснюється натрій-залежним способом. Цей білок є мішенню для багатьох антидепресантів, таких як SSRI (англ. selective serotonin reuptake inhibitor) та трициклічних антидепресантів[1]. Він належить до родини натрій-нейромедіаторних симпортерів (англ. sodium:neurotransmitter symporter family). Поліморфний варіант гену, що кодує цей білок, має довшу послідовність нуклеотидів (за рахунок повторів) зі сторони промоторної ділянки і таким чином збільшує швидкість зворотнього захоплення серотоніну, що може відігравати роль в синдромі раптової дитячої смерті, агресивній поведінці в пацієнтів з хворобою Альцгеймера, посттравматичному стресовому розладі й чутливості до депресії у людей, що переживають емоційну травму[2].
Медичні дослідження показали, що зміни в активності SERT, очевидно, пов'язані з багатьма різними явищами, а саме алкоголізмом[3], клінічною депресією, обсесивно-компульсивним розладом (ОКР), романтичним коханням, гіпертонією і соціофобією[4].
SERT також присутній в тромбоцитах; там, серотонін є речовиною, що виконує судинозвужувальну функцію. Ця речовина також служить як сигнальна молекула для індукування агрегації тромбоцитів.

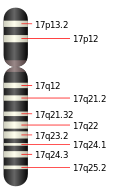
Ген, який кодує серотоніновий транспортер називається SLC6A4. У людини цей ген розташований на довгому плечі 17-ї хромосоми у позиції 17q11.1–q12[6].
Мутації, пов'язані з цим геном, можуть викликати зміни в функціонуванні серотонінового транспортеру, а експерименти з мишами виявили понад 50 різних змін в результаті генетичної мінливості. Цими фенотипічними змінами можуть, наприклад, бути підвищена тривожність і дисфункції кишечника[7]. Деякі з генетичних варіацій людини, пов'язаних з цим геном є[7]:
- варіювання довжини поліморфної області 5-HTTLPR (англ. 5-hydroxytryptamine-transporter-linked polymorphic region);
- rs25531 — однонуклеотидний поліморфізм в 5-HTTLPR;
- rs25532 — інший однонуклеотидний поліморфізм в 5-HTTLPR;
- STin2 — варіювання кількості тандемних повторів (VNTR) в 2-му функціональному інтроні;
- G56A на другому екзоні;
- I425V на дев'ятому екзоні.
| Цей розділ потребує доповнення. (жовтень 2016) |
rs25532 є однонуклеотидним поліморфізмом (C>T), що розташований поруч з 5-HTTLPR. Він розглядається, як асоційований з обсесивно-компульсивними розладами[8].
I425V рідкісна мутація на дев'ятому екзоні. Дослідники виявили цей генетичний варіант в неспоріднених сімей з обсесивно-компульсивними розладами, і що він зумовлює неправильне функціонування і регулювання серотонінового транспортера. Другий варіант в тому ж гені деяких пацієнтів з цією мутацією передбачає генетичний «подвійний удар», що призводить до підвищення біохімічних ефектів і більш важких симптомів[9][10][11].
Іншим некодуючим поліморфізмом є варіювання кількості тандемних повторів в другому інтроні (STin2). Веявлено три алелі з 9, 10 і 12 повторами. Мета-аналіз виявив, що алель з 12 тандемними повторами має деякі незначні (з співвідношенням ймовірностей 1,24), але статистично значущі кореляції з шизофренією[12]. У 2008 році мета-аналіз не виявив істотної кореляції між варіюванням кількості тандемних повторів в другому інтроні гену SLC6A4 і аутизмом[13]. Крім того, в 2003 мета-аналіз афективних розладів, клінічних депресій та біполярних рзладів виявив невеликі кореляції з варіюванням кількості тандемних повторів в STin2, але на результати мета-аналізу можуть мати значний вплив дані від одного окремого дослідження[14].
Згідно з дослідженнями російських науковців проведеними в 2008 р., цей поліморфізм виявляє кореляції з деякими рисами особистості. Носії алелю з 10 тандемними повторами, проходячи тестувння за особистісним опитувальником Айзенка, отримують низький бал нейротизму[15].
Поширення серотонінового транспортера в головному мозку може бути візуалізована за допомогою за допомогою позитрон-емісійної томографії з використанням радіолігандів, що звуться DASB і DAPP, а перші дослідження людського мозку було зареєстровано в 2000 році[16]. DASB і DAPP не є єдиними радіолігандами для SERT. Є безліч інших, найбільш популярними з яких, ймовірно, є радіоліганд β-CIT з ізотопом йоду-123, який використовується для сканування мозку з використанням однофотонної емісійної комп'ютерної томографії (SPECT)[17]. Радіоліганди були використані для дослідження питання, чи є такі змінні, як вік, стать або генотип асоційовані з зв'язуванням диференційованого серотонінового транспортера[18] . Здорові суб'єкти, які мали високий бал невротизму — риса особистості в Revised NEO Personality Inventory — виявляли більше зв'язування SERT в таламусі[19].
Дослідження серотонінового транспортеру поєднали методи нейровізуалізації і генетики, наприклад, дослідження з застосуванням воксельної морфометрії виявили менше сірої речовини в навколоколінній передній поясній корі і мигдалині для носіїв коротких аллелів з 5-HTTLPR поліморфізмом в порівнянні з носіями «long/long» генотипу[20].
- ↑ Squire, edited by Larry та ін. (2008). Fundamental neuroscience (вид. 3rd). Amsterdam: Elsevier / Academic Press. с. 143. ISBN 978-0-12-374019-9.
- ↑ Entrez Gene: SLC6A4 solute carrier family 6 (neurotransmitter transporter, serotonin), member 4.
- ↑ Marazziti D, Akiskal HS, Rossi A, Cassano GB (May 1999). Alteration of the platelet serotonin transporter in romantic love. Psychological Medicine. 29 (3): 741—5. doi:10.1017/S0033291798007946. PMID 10405096.
- ↑ van der Wee NJ, van Veen JF, Stevens H, van Vliet IM, van Rijk PP, Westenberg HG (May 2008). Increased serotonin and dopamine transporter binding in psychotropic medication-naive patients with generalized social anxiety disorder shown by 123I-beta-(4-iodophenyl)-tropane SPECT. Journal of Nuclear Medicine. 49 (5): 757—63. doi:10.2967/jnumed.107.045518. PMID 18413401.
- ↑ Dahlin A, Royall J, Hohmann JG, Wang J (May 2009). Expression profiling of the solute carrier gene family in the mouse brain. The Journal of Pharmacology and Experimental Therapeutics. 329 (2): 558—70. doi:10.1124/jpet.108.149831. PMC 2672879. PMID 19179540.
- ↑ Nakamura M, Ueno S, Sano A, Tanabe H (January 2000). The human serotonin transporter gene linked polymorphism (5-HTTLPR) shows ten novel allelic variants. Molecular Psychiatry. 5 (1): 32—8. doi:10.1038/sj.mp.4000698. PMID 10673766.
- ↑ а б Murphy DL, Lesch KP (February 2008). Targeting the murine serotonin transporter: insights into human neurobiology. Nature Reviews. Neuroscience. 9 (2): 85—96. doi:10.1038/nrn2284. PMID 18209729.
- ↑ Wendland JR, Moya PR, Kruse MR, Ren-Patterson RF, Jensen CL, Timpano KR, Murphy DL (March 2008). A novel, putative gain-of-function haplotype at SLC6A4 associates with obsessive-compulsive disorder. Human Molecular Genetics. 17 (5): 717—23. doi:10.1093/hmg/ddm343. PMID 18055562.
- ↑ Ozaki N, Goldman D, Kaye WH, Plotnicov K, Greenberg BD, Lappalainen J, Rudnick G, Murphy DL (November 2003). Serotonin transporter missense mutation associated with a complex neuropsychiatric phenotype. Molecular Psychiatry. 8 (11): 933—6. doi:10.1038/sj.mp.4001365. PMID 14593431.
News article:
- Reuters (27 October 2003). Gene Found for Obsessive-Compulsive Disorder. Mental Health E-News. Архів оригіналу за 6 жовтня 2006. Процитовано 25 January 2008.
- ↑ Delorme R, Betancur C, Wagner M, Krebs MO, Gorwood P, Pearl P, Nygren G, Durand CM, Buhtz F, Pickering P, Melke J, Ruhrmann S, Anckarsäter H, Chabane N, Kipman A, Reck C, Millet B, Roy I, Mouren-Simeoni MC, Maier W, Råstam M, Gillberg C, Leboyer M, Bourgeron T (December 2005). Support for the association between the rare functional variant I425V of the serotonin transporter gene and susceptibility to obsessive compulsive disorder. Molecular Psychiatry. 10 (12): 1059—61. doi:10.1038/sj.mp.4001728. PMC 2547479. PMID 16088327.
- ↑ Stephen Wheless. "The OCD Gene" Popular Press v. Scientific Literature: Is SERT Responsible for Obsessive-Compulsive Disorder?. Davidson College. Процитовано 12 June 2008.
- ↑ Fan JB, Sklar P (October 2005). Meta-analysis reveals association between serotonin transporter gene STin2 VNTR polymorphism and schizophrenia. Molecular Psychiatry. 10 (10): 928—38, 891. doi:10.1038/sj.mp.4001690. PMID 15940296.
- ↑ Huang CH, Santangelo SL (вересень 2008). Autism and serotonin transporter gene polymorphisms: a systematic review and meta-analysis. American Journal of Medical Genetics Part B. 147B (6): 903—13. doi:10.1002/ajmg.b.30720. PMID 18286633.
- ↑ Anguelova M, Benkelfat C, Turecki G (June 2003). A systematic review of association studies investigating genes coding for serotonin receptors and the serotonin transporter: I. Affective disorders. Molecular Psychiatry. 8 (6): 574—91. doi:10.1038/sj.mp.4001328. PMID 12851635.
- ↑ Kazantseva AV, Gaysina DA, Faskhutdinova GG, Noskova T, Malykh SB, Khusnutdinova EK (August 2008). Polymorphisms of the serotonin transporter gene (5-HTTLPR, A/G SNP in 5-HTTLPR, and STin2 VNTR) and their relation to personality traits in healthy individuals from Russia. Psychiatric Genetics. 18 (4): 167—76. doi:10.1097/YPG.0b013e328304deb8. PMID 18628678.
- ↑ Houle S, Ginovart N, Hussey D, Meyer JH, Wilson AA (November 2000). Imaging the serotonin transporter with positron emission tomography: initial human studies with [11C]DAPP and [11C]DASB. European Journal of Nuclear Medicine. 27 (11): 1719—22. doi:10.1007/s002590000365. PMID 11105830.
- ↑ Brücke T, Kornhuber J, Angelberger P, Asenbaum S, Frassine H, Podreka I (1993). SPECT imaging of dopamine and serotonin transporters with [123I]beta-CIT. Binding kinetics in the human brain. Journal of Neural Transmission. General Section. 94 (2): 137—46. doi:10.1007/BF01245007. PMID 8110440.
- ↑ Brust P; Hess S; Müller U; Szabo Z (February 2006). Neuroimaging of the Serotonin Transporter — Possibilities and Pitfalls (PDF). Current Psychiatry Reviews. 2 (1): 111—149. doi:10.2174/157340006775101508. Архів оригіналу (PDF) за 23 липня 2011. Процитовано 24 жовтня 2016.
- ↑ Takano A, Arakawa R, Hayashi M, Takahashi H, Ito H, Suhara T (September 2007). Relationship between neuroticism personality trait and serotonin transporter binding. Biological Psychiatry. 62 (6): 588—92. doi:10.1016/j.biopsych.2006.11.007. PMID 17336939.
- ↑ Pezawas L, Meyer-Lindenberg A, Drabant EM, Verchinski BA, Munoz KE, Kolachana BS, Egan MF, Mattay VS, Hariri AR, Weinberger DR (червень 2005). 5-HTTLPR polymorphism impacts human cingulate-amygdala interactions: a genetic susceptibility mechanism for depression. Nature Neuroscience. 8 (6): 828—34. doi:10.1038/nn1463. PMID 15880108.
| Це незавершена стаття з клітинної біології. Ви можете допомогти проєкту, виправивши або дописавши її. |
| Це незавершена стаття з біохімії. Ви можете допомогти проєкту, виправивши або дописавши її. |